- Què és la microbiota intestinal?
- Com es forma la microbiota al llarg de la vida?
- Quines funcions té la microbiota intestinal?
- La microbiota: som diferents, però compartim un “nucli” comú
- Quan hi ha desequilibri: la disbiosi
- Un cas paradigmàtic: Clostridioides difficile
- Trasplantament de microbiota fecal (TMF)
- Com podem cuidar la microbiota?
- Unitat de Microbioma
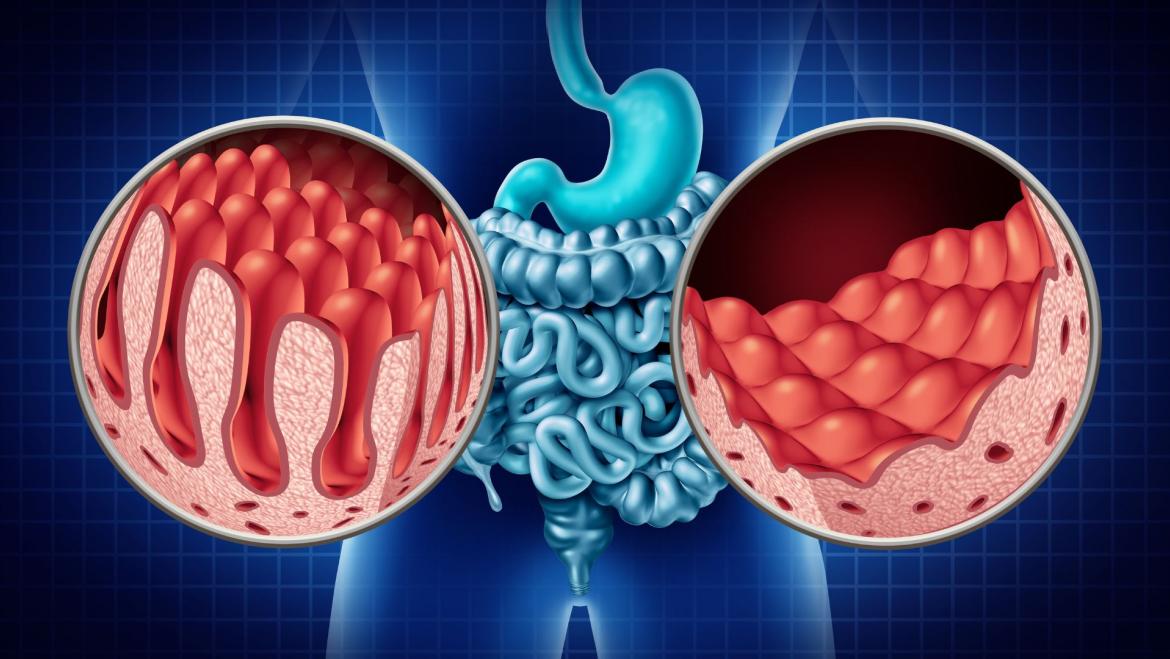
La microbiota intestinal és el conjunt de microorganismes (sobretot bacteris) que viuen al nostre intestí i que formen una comunitat molt nombrosa i diversa. Es calcula que hi ha milers de milions de microorganismes per gram de femta i que, en total, poden arribar a pesar aproximadament 2 kg. Aquesta comunitat disposa d’un nombre de gens molt superior al del nostre propi genoma i actua gairebé com un òrgan més del cos.
La microbiota comença a establir-se molt aviat, des dels primers moments de vida, i evoluciona durant la infància fins a adquirir un perfil similar al d’una persona adulta, aproximadament cap als 3 anys. Diversos factors influeixen en aquesta configuració:
- Tipus de part (vaginal o cesària)
- Alimentació inicial (llet materna o fórmula)
- Introducció progressiva dels aliments sòlids durant el deslletament
- Ús d’antibiòtics i altres medicaments
- Factors ambientals, genètics i d’estil de vida
El període del deslletament és especialment important perquè es produeix una “reacció” del sistema immunitari a la nova microbiota, que contribueix a la seva maduració i pot influir en el risc de patir malalties immunomediades més endavant.
La microbiota intestinal participa en nombrosos processos essencials per a la salut:
- Funció metabòlica: fermenta la fibra que l’organisme no pot digerir, genera energia per a les cèl·lules intestinals, metabolitza substàncies externes i contribueix a la síntesi de vitamines com la vitamina K, els folats i la biotina
- Funció de protecció: competeix amb microorganismes patògens, produeix substàncies antibacterianes i afavoreix la secreció d’IgA, un anticòs clau en la defensa de les mucoses
- Funció immunològica: és fonamental per al desenvolupament i la regulació del sistema immunitari intestinal, ajudant a mantenir un equilibri entre resposta defensiva i tolerància
- Manteniment de la barrera intestinal: contribueix a preservar la integritat de la mucosa, enforteix les unions entre cèl·lules i participa en la producció de muc i pèptids antimicrobians, evitant el pas de substàncies nocives a la sang
Cada persona té una microbiota pròpia, influïda per la genètica, la dieta, l’entorn i el tractament amb medicaments, entre d’altres factors. Tot i això, els estudis indiquen que existeix un “nucli” funcional comú: diferents individus poden tenir bacteris concrets diferents, però amb capacitats metabòliques i de regulació de la salut molt semblants.
Es parla de disbiosi quan es produeix una alteració de la composició i/o de la diversitat de la microbiota, amb pèrdua de funcions beneficioses. Aquesta disbiosi s’ha relacionat amb diverses malalties:
- Trastorns digestius: infecció per Clostridioides difficile, malaltia inflamatòria intestinal (malaltia de Crohn, colitis ulcerosa), síndrome de l’intestí irritable
- Malalties metabòliques i cardiovasculars: obesitat, síndrome metabòlica, diabetis tipus 2, arterioesclerosi
- Malalties immunològiques i al·lèrgiques: asma i altres processos inflamatoris
- Alguns trastorns neurològics i del comportament: relacions descrites amb autisme i altres trastorns, tot i que encara s’estan estudiant
- En la majoria de casos es tracta d’associacions i, per tant, cal prudència: no sempre està clar si la disbiosi és la causa de la malaltia, una conseqüència o totes dues coses alhora
La infecció per Clostridioides difficile (ICD) és un exemple clar de la importància de la microbiota. Sovint apareix després de tractaments amb antibiòtics que alteren profundament els bacteris intestinals. Quan la microbiota sana està intacta, facilita la producció de metabòlits (com els àcids biliars secundaris i els àcids grassos de cadena curta) que dificulten la germinació i el creixement de C. difficile i mantenen la barrera intestinal en bon estat.
Quan aquesta microbiota es veu danyada per antibiòtics, es perd la protecció: la barrera mucosa es debilita i C. difficile pot proliferar, produir toxines i causar diarrea greu. Malgrat que tractaments com la vancomicina o la fidaxomicina acostumen a controlar el primer episodi, fins a un 25% dels pacients poden presentar recurrències, i després d’una primera recurrència el risc de noves recaigudes pot arribar al 45–65%.
El trasplantament de microbiota fecal consisteix a administrar microbiota procedent d’un donant sa a l’intestí d’un pacient, amb l’objectiu de restaurar un ecosistema intestinal divers i funcional. És un procediment que s’ha anat perfeccionant al llarg de les darreres dècades i que ara es pot fer mitjançant colonoscòpia, sonda digestiva o càpsules formulades específicament.
En el cas de la infecció recurrent per C. difficile, diversos assaigs clínics han demostrat que el TMF pot aconseguir taxes de curació superiors al tractament antibiòtic convencional, amb percentatges globals que en alguns estudis arriben al 80–90% després d’una o poques infusions. A més, s’ha observat que, després del TMF, la diversitat de la microbiota dels receptors s’assembla més a la dels donants sans.
L’ús del TMF en altres patologies, com la colitis ulcerosa o en combinació amb immunoteràpia oncològica, és un camp en expansió, però en molts casos encara es considera una estratègia en fase d’estudi i d’avaluació.
Alguns hàbits poden contribuir positivament a la salut de la microbiota intestinal:
- Seguir una alimentació rica en fibra (fruita, verdura, llegums, cereals integrals) i amb aliments d’origen vegetal variats
- Incloure, si és possible i recomanat, aliments fermentats (per exemple, alguns iogurts i productes lactis fermentats)
- Evitar l’abús d’aliments ultraprocessats, greixos poc saludables i sucres refinats
- Fer activitat física de manera regular i adaptar-la a cada situació personal
- Dormir i descansar adequadament i gestionar l’estrès
- Utilitzar els antibiòtics només quan són realment necessaris i sempre sota indicació professional
L’Hospital Universitari de Bellvitge s’ha convertit en centre de referència a Catalunya i a l’Estat en l’estudi del microbioma humà, la comunitat de microorganismes variables que habita a l’aparell digestiu i a altres àrees del cos humà. La recerca en aquest àmbit ens permetrà descobrir més del nostre sistema biològic: com intervé el microbioma en els processos de defensa contra les infeccions, com influeix en el nostre sistema immunitari o la seva implicació en la salut o en certes malalties.
El primer pas ha estat la creació d’una Unitat Transversal que potencia el Trasplantament de Microbiota Fecal (TMF) per a infeccions causades per Clostridiodes difficile. Aquest bacteri produeix danys greus al colon posant, en certs casos, en risc la vida de pacients. En els casos d’infecció recidivant, el TMF és considerada l’estratègia més eficaç, superior al tractament antibiòtic.
Per combatre el C. difficile, la nostra Unitat produeix càpsules liofilitzades a partir de la femta de donants amb un microbioma intestinal sa. Aquest és un tractament oral innovador i eficaç en menys de 48 hores. L’Hospital Universitari de Bellvitge és l’únic centre de Catalunya que és capaç de fabricar càpsules liofilitzades de microbiota intestinal.
En paral·lel, impulsa un Banc de Microbiota. Aquest Banc fa possible, d’una banda, facilitar el TMF a pacients ingressats en altres hospitals; d’altra banda, iniciar programes experimentals per explorar l’ús d’aquest trasplantament pioner en altres patologies.
Per poder tenir perfectament caracteritzat el microbioma de les mostres dipositades al Banc, és indispensable l’anàlisi d’aquestes mitjançant tècniques de seqüenciació de nova generació (NGS). Aquesta metodologia permet analitzar i quantificar la diversitat microbiana de les mostres de donants i receptors, avaluant l’impacte del TMF en altres contexts clínics. L’estudi del microbioma per NGS revolucionarà el diagnòstic microbiològic clínic en els pròxims anys i probablement contribuirà de forma important a la medicina personalitzada del futur.